- පරමාණුවක වටේට ඉලෙක්ට්රෝන වලාවක් සේ චලනය වන අතර පරමාණුව මැද වූ න්යෂ්ටියේ ප්රෝටෝන හා නියුට්රෝන පිහිටා ඇතැයි අපි දනිමු.
- ඉලෙක්ට්රෝන පරමාණුව වටා ක්රමානුකූලව විවිධ ශක්ති මට්ටම් වල පිහිටා ඇත. ඉලෙක්ට්රෝන ඒ වටා ගමන් කරයි.
- උදාහරණයක් ලෙස පන්ති කාමරයක් සළකමු. ගුරුවරයාගේ මේසයට ආසන්නයෙන්ම ඇති පේළියේ මේස දෙකක්ද ඊළඟ පේළියේ මේස අටක්ද ඊළඟ පේළියේත් මේස අටක්ද අවසාන පේළියේ මේස 32 ක්ද ඇත. මෙම පේළි ශක්ති මට්ටම් ලෙස සැළකූ විට, ඉලෙක්ට්රෝන ලෙස මේස සැළකිය හැක.
- පන්තියට එන පළමු සිසුන් දෙදෙනාට පළමු පේළියේ හිඳ ගත හැක. නමුත් තෙවැන්නාට එහි ඉඩ නොමැති බැවින් ඉඳ ගැනීමට සිදුවන්නේ දෙවන පේළියේය. මින් පසු දහවන සිසුවා දක්වාම අය දෙවන පේළියේ හිඳ ගනී. මීළඟ සිසුවාගේ සිට 18 වැන්නා දක්වා තූන් වන පේළියේ හිඳ ගනී. 4 වන පේළියේ හිඳ ගන්නේ මීළඟ සිසුන් 18 දෙනාටය.
- විද්යාඥයන්ගේ මතයට අනුව පරමාණු වල ඉලෙක්ට්රෝන පිහිටා ඇත්තේ ඉහත සිසුන් හිඳගත් පරිදිය.
- මෙහිදී න්යෂ්ටිය ලෙස සැළකෙන්නේ ගූරුවරයාගේ මේසයයි.තවද මෙහි පේළි ශක්ති මට්ටම් ලෙසත් සිසුන් ඉලෙක්ට්රෝන ලෙසත් සැළකේ.
- ඉලෙක්ට්රෝනයක් පෙන්නුම් කරයි.
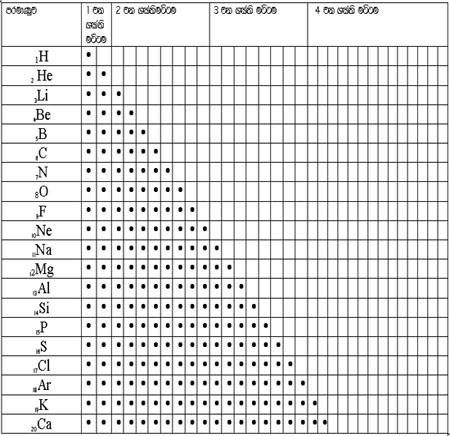
පහත දැක්වෙන වගුව නිරීක්ෂණය කරන්න.
| පරමාණු | පරමාණුක ක්රමාංක | ස්කන්ධ ක්රමාංකය | නියුට්රෝන | ප්රෝටෝන | ඉලෙක්ට්රෝන වින්යාස |
| N | 7 | 14 | 7 | 7 | 2,5 |
| Mg | 12 | 24 | 12 | 12 | 2,8,2 |
| Al | 13 | 27 | 14 | 13 | 2,8,3 |
| Ca | 20 | 40 | 20 | 20 | 2,8,8,2 |
 ශිල්ප 64
ශිල්ප 64